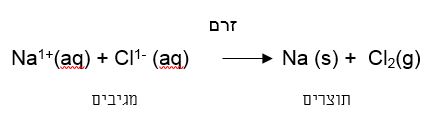חלקיקי התרכובת בנויים מאטומים מסוגים שונים. תרכובת נוצרת מתגובה כימית בין שני חומרים טהורים. התרכובת היא חומר טהור. בעוד שבטבע יש מספר מוגבל (כ-100) של יסודות הרי שקיים מספר גדול מאוד של תרכובות. תכונות התרכובות שונות מתכונות היסודות שיצרו אותם. התרכובת מיוצגת באמצעות שפת הכימאים על ידי הנוסחה הכימית. אחת התרכובת המוכרות
היא התרכובת של נתן כלורי, מלח בישול, NaCl. זוהי תרכובת יונית הבנויה מיונים חיוביים של נתרן ויונים שליליים של כלור. כידוע, מלח בישול מוצק בטמפרטורת החדר.
האם ניתן לפרק מלח בישול ולקבל מהפירוק את היונים המרכיבים אותו?
פעילות זו מדמה את תהליך הפירוק של מלח בישול במעבדה, באמצעות העברת זרם חשמלי, תהליך המכונה אלקטרוליזה (אלקטרו – חשמל, ליזיס – פירוק).
את התגובה הכימית- אלקטרוליזה של תמיסת נתרן כלורי (מלח בישול) – מנסחים בשפת הכימיה באופן הבא:
יודגש כי על מנת לבצע פירוק של התרכובת היונית על ידי חשמל (אלקטרוליזה), יש צורך בספק או בסוללה.
כיתה: ח'
נושא מרכזי: חומרים (כימיה)
מבנה החומר:
- מבנה האטום, היסודות ותכונותיהם, ארגון היסודות בטבלת היסודות
- תרכובות ותערובות
- תהליכי שינוי בחומרים וחוק שימור המסה
נושאי משנה:
- מבנה החומר:
- מבנה האטום, היסודות ותכונותיהם, ארגון היסודות בטבלת היסודות
- תרכובות ותערובות
- תהליכי שינוי בחומרים וחוק שימור המסה
מיומנויות:. מידענות, ייצוג מידע
מילות מפתח: פעילות לתלמיד, הדמיה, אטום, יסוד, תרכובת, חומר טהור, אלקטרוליזה, מלח בישול, NaCl, תרכובת יונית, יון חיובי, יון שלילי, אלקטרודה, מצב צבירה, יישום